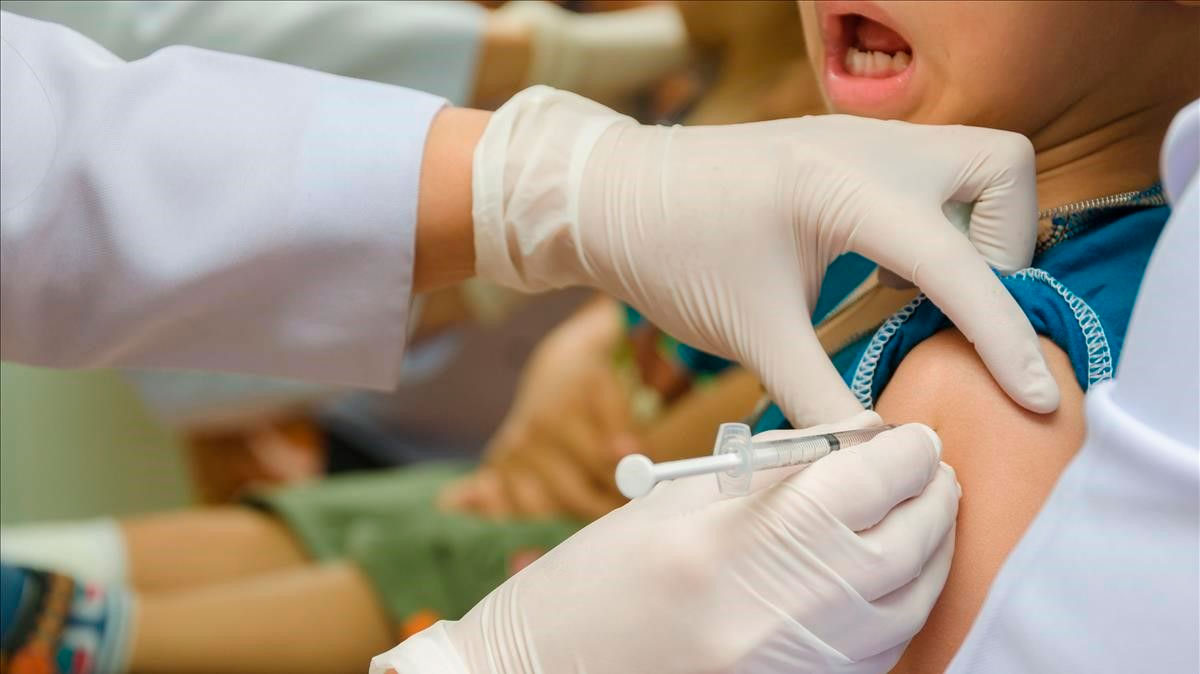
(El Financiero) Pfizer informó que su vacuna contra el COVID-19 es segura y que produjo fuertes respuestas de anticuerpos en niños de 5 a 11 años en un ensayo a gran escala. Lo anterior podría ser el inicio para empezar a vacunar a los niños de educación primaria en unos meses.
Los esperados resultados ofrecen uno de los primeros indicios de la eficacia de la vacuna contra el coronavirus en los niños más pequeños. La presión para vacunar a los niños ha ido en aumento en Estados Unidos, donde el nuevo año escolar comienza justo cuando la variante delta está impulsando un alza de los casos.
En un ensayo con 2 mil 268 participantes, dos inyecciones de una dosis de 10 microgramos —un tercio de la dosis para adultos— produjeron niveles de anticuerpos comparables a los observados en un ensayo con jóvenes de 16 a 25 años que recibieron la dosis para adultos, informaron las empresas, con efectos secundarios similares.
Pfizer y BioNTech dijeron que planean presentar los datos como parte de una solicitud a corto plazo de autorización de uso de emergencia de la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) de EE.UU, y también compartirlos con los reguladores en Europa.
Una autorización marcaría una nueva e importante fase de la campaña de inmunización en EU, donde la vacuna de Pfizer ya está plenamente aprobada para personas de 16 años en adelante y está autorizada con carácter de emergencia para jóvenes de entres 12 y 15 años . Asimismo, la autorización pediátrica podría llegar cuando millones de estadounidenses mayores estén recibiendo dosis adicionales para reforzar sus vacunas iniciales.
Se espera que la FDA decida si autoriza una dosis de refuerzo para la vacuna de Pfizer-BioNTech en los próximos días.
El viernes, un grupo de asesores respaldó por unanimidad una tercera dosis para las personas de 65 años o más, así como para aquellos con alto riesgo de complicaciones graves, tras votar en contra de la petición de Pfizer de autorizar refuerzos para todos los mayores de 16 años.
Aunque la FDA suele seguir a sus asesores, no está obligada a hacerlo, y aún podría optar por apoyar los refuerzos para un grupo mayor. Solo algunas personas inmunocomprometidas están ahora oficialmente autorizadas a recibir una tercera dosis sobre una base de emergencia.
Los datos iniciales de otras ramas del ensayo pediátrico Pfizer-BioNTech, que prueba la vacuna en niños menores de 5 años, podrían conocerse en el cuarto trimestre, dijeron las compañías.
Notas relacionadas
Opinión
Editorial
La reforma salarial y los intereses patronales
Más de ocho meses han transcurrido después de que el Senado de la República aprobara una reforma que modifica el Artículo 123º Constitucional con el fin de mejorar las condiciones de vida de los trabajadores y sus familias.











Escrito por Redacción